
Saturniidae jest dużą rodziną ciem (około 2300 gatunków) i jest także rodziną dużych ciem, włącznie z niektórymi największymi i najpiękniejszymi na świecie.
Oto jedna z nich: Actias luna; ta ćma jest samicą. Proszę zauważyć dwie cechy tego owada: długie „ogony” na tylnych skrzydłach i oczka pawie na tych samych skrzydłach. Jest jeszcze jedna cecha, której nie widać: podobnie jak jętki, dorosłe wykluwają się bez części gębowej, a więc nie mogą jeść. Żyją tylko po to, by kopulować i stworzyć następne pokolenie, i umierają w tydzień po wydostaniu się z kokonu.
Wiadomo było od pewnego czasu (dzięki eksperymentom), że pawie oczka służą do zdezorientowania drapieżników, głównie ptaków, które je atakują i choć mogą uszkodzić skrzydła, nie dziobią w głowę i tułów, dając dziobniętej ćmie szansę ucieczki. Jest w tym oczywista korzyść selekcyjna. (U niektórych łuskoskrzydłych pawie oczka mogą także odstraszyć napastnika, bo przypominają oczy groźnych ptaków, takich jak sowy.)Ale o co chodzi z tymi długimi ogonami? Nowy artykuł w Proceedings of the National Academy of Sciences (US) autorstwa Jesse Barbera i kolegów (odnośnik poniżej; darmowe streszczenie i pdf) sugeruje, że pomagają dezorientować drapieżne nietoperze. Podobnie jak większość ciem, Saturniidae na ogół latają w nocy, a więc są obiektem polowań zwierząt, które nie widzą zbyt dobrze: w tym nietoperzy! Nietoperze polują przy pomocy sonaru i autorzy sprawdzali hipotezę, że „ogony” ciem, które kręcą się i ruszają podczas lotu, stanowią atrakcję dla nietoperzy. Nietoperze atakują je i zostawiają tułów w spokoju. Pojawiła sie hipoteza, że te ogony wyewoluowały, by pomóc ćmom w ucieczce przed drapieżnikami.
Badacze wpuścili ćmy Actias luna razem z mroczkami brunatnymi (Eptesicus fuscus) do zaciemnionego i dźwiękoszczelnego pomieszczenia i filmowali w podczerwieni, co się dzieje, (oraz przysłuchiwali się również przy pomocy ultra czułych mikrofonów). Mieli tam osiem nietoperzy i 162 ćmy, jak również ćmy „kontrolne”. W każdej próbie wpuszczali do pomieszczenia jedną nienaruszoną ćmę Actias luna, jedną Actias luna z usuniętym ogonem, jak również kontrolną ćmę omacnicowatą. Dla wygody filmowania ćmy były przywiązane do sufitu długimi włóknami monofilament. Actias luna i mroczki brunatne nie żyją w tych samych miejscach w przyrodzie, więc nietoperze polowały na ćmy, których nigdy przedtem nie „widziały”.
Oto wyniki podane w tym artykule, pokazujące, że ćmy z ogonami miały znacznie większe szanse przeżycia takiego eksperymentu (można także obejrzeć pięć filmów,< które pokazują zachowania nietoperzy). Podkreślenie w poniższym jest moje:
Nietoperze schwytały 34,5% (liczba obecnych ciem; n = 87) Actis luna i 81,3% (n = 75) ciem bez ogonów – przewaga w przeżyciu 46,8% dla ciem z ogonami na tylnych skrzydłach (Fig. 1). Regresja logistyczna układów mieszanych ujawniła, że ćma bez ogona ma 8,7 razy większe prawdopodobieństwo [przedział ufności (CI) = 2,1–35,3] złapania niż ćma z ogonami. Podczas każdej sesji dawaliśmy nietoperzowi jedną nienaruszoną Actias luna, jedną A. luna z usuniętym ogonem i 1-2 ćmy omacnicowate jako kontrolę. Ćmy kontrolne były chwytane w 97,5% (n = 136) przypadkach.
Nietoperze mniej więcej w połowie przypadków atakowały ogony nienaruszonych ciem, a kiedy to robiły, udawało im się złapać ćmę tylko w 4% wypadków. Kiedy jednak atakowały tułów ćmy z zachowanym ogonem równie często udawało im się ją zabić, jak wtedy, kiedy atakowały ćmy z usuniętymi ogonami (72%).
Choć te wyniki są silną wskazówką, że ogony mogły wyewoluować, by pomóc ćmom w umknięciu nietoperzowi, jest tu kilka zastrzeżeń.
1. Być może trudniej było złapać ćmy z ogonami po prostu dlatego, że były większe niż ćmy bez ogonów. Mroczki brunatne łapią ćmy przez objęcie ich skrzydłem, a następnie zagarnięcie do jamy gębowej. Być może, jest po prostu trudniej złapać w ten sposób ćmy z ogonami, a więc ogony nie wyewoluowały, by dezorientować nietoperze, ale by trudniej było je zgarniać. Dla sprawdzenia tego autorzy dali nietoperzom inne ćmy z rodziny Saturniidae, które nie mają ogonów (Antheraea polyphemus), ale mają jeszcze większe ciała i skrzydła niż Actias luna, co sugeruje, że większa powierzchnia ma znaczenie, ale efekt nie był wystarczająco duży, by wyjaśnić różnicę między całą ćmą i ćmą z usuniętym ogonem. Jednak prawdopodobieństwo, że ogony mają znaczenie poza zwiększeniem rozmiaru, nie było imponujące: wartość p (prawdopodobieństwo, że ogony nie mają prawdziwego znaczenie poza tym, które pojawia się przypadkowo) była marginalnie znacząca – mniej niż 5%. Jest to znaczące statystycznie, ale niezbyt imponujące.
2. Być może, istnieją inne naciski selekcyjne, które wyjaśniają ogony u ciem. Jednym z proponowanych wyjaśnień jest to,że pomagają ćmom lepiej latać. Autorzy przeanalizowali latanie ciem nienaruszonych i ciem z obciętymi ogonami i stwierdzili, że zmieniła się tylko częstotliwość uderzeń skrzydłami z 10 do 11 HZ (czymkolwiek to jest) – ale twierdzą, że nie zmieniła się żadna cecha lotu, która mogłaby pomóc ćmom w unikaniu drapieżników.
No dobrze, to już jest coś. Ale co z doborem płciowym? Czy długie ogony mogą być atrakcyjne dla samic, samców lub jednych i drugich? Autorzy uważają to za mało prawdopodobne, ponieważ samce i samice mają ogony o podobnych wymiarach (cechy dobrane płciowo często różnią się wielkością lub złożonością między płciami i zazwyczaj samce mają większe lub bardziej złożone cechy). Ponadto ćmy kopulują w nocy i nie używają wizualnych wskazówek przy łączeniu się w pary. U niektórych gatunków ciem samce mają jednak dłuższe ogony niż samice, ale autorzy mówią, że może to być spowodowane nie doborem płciowym, ale naciskiem ze strony drapieżników: samce spędzają więcej czasu na lataniu niż samice, bo latają w poszukiwaniu samic, a więc są pod większym naciskiem unikania drapieżników. Brzmi to trochę jak powoływanie się na szczególne okoliczności.
W sumie sądzę jednak, że autorzy mają rozsądny argument na to, że ogony utrudniają ataki drapieżników, chociaż miło byłoby zobaczyć eksperymenty z innymi gatunkami ciem z ogonami. Ponadto, niska istotność tych wyników, szczególnie w testach na hipotezę o wymiarach ciała, jest nieco niepokojąca. Niemniej wyniki są lepsze niż zwykłe popatrzenie na ćmy i wymyślenie adaptacyjnej opowieści bez przetestowania jej! Było bardzo trudno przeprowadzić ten eksperyment.
Wreszcie, autorzy chcieli wiedzieć, jak wiele razy ogony Saturniidae wyewoluowały niezależnie. Zestawili drzewo rodowe grupy używając pięciu genów jądrowych i jednego mitochondrialnego, a następnie nałożyli na to rozmiary ogonów. Drzewo filogenetyczne + diagram rozmiarów ogonów pokazane poniżej pokazuje wyraźnie, że długie ogony wyewoluowały w tej grupie niezależnie co najmniej cztery razy (zacienione na szaro części drzewa). Dałem oryginalny podpis (nie spolszczony. MK), żebyście zobaczyli, co znaczą kolory:
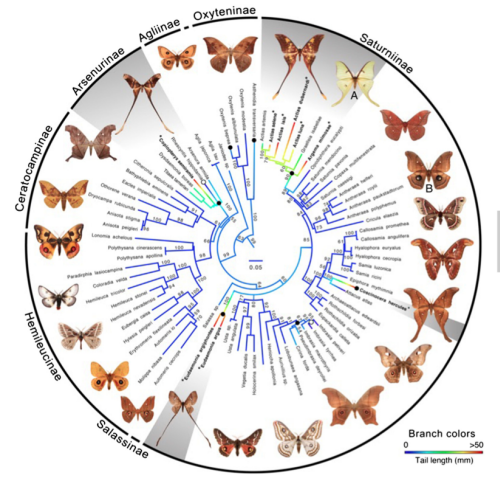
ML molecular phylogeny of saturniid moths showing multiple independent origins of hindwing tails. Filled black circles indicate origin of tails. Open circles indicate losses. Branch colors indicate length of hindwing tail from absent (blue) to >50 mm (red), based on Phytools continuous character evolution analyses. Numbers by branches are bootstrap values. Gray shading denotes groups that have spatulate tails and contain species with tail lengths greater than 37.5 mm (the average for A. luna, n = 10). The images of saturniid moths used in these experiments are labeled: (A) A. luna and (B) A. polypheumus. Bold type and asterisks denote species that have tails longer than 37.5 mm. In combination with our bat–moth interaction data, this phylogeny suggests that tails serving a clear anti-bat function have evolved 4 times. Three additional origins of very short tails, of uncertain function, are also apparent.
Można to zakończyć klasycznym banałem często używanym przy wnioskach z badań naukowych: “Potrzebne są dalsze badania”. Niemniej wiemy nieco więcej niż wiedzieliśmy przedtem i te wyniki mogą prowadzić innych do odkrycia dodatkowych i nieoczywistych strategii przeciwko drapieżnikom wśród ciem. Jak to do znudzenia powtarzamy w grze Darwina: „Ewolucja jest mądrzejsza od ciebie”. ______________
Barber, J. R., B. C. Leavell, A. L. Keener, J. W. Breinholt, B. A. Chadwell, C. J. W. McClure, G. M. Hill, and A. Y. Kawahara. 2015 Moth tails divert bat attack: Evolution of acoustic deflection. Proc. Nat. Acad. Sci. USA, early edition, 10.1073/pnas.1421926112
h/t: William
A tail of moths and bats a novel anti-predator trait
Why Evolution Is True, 18 lutego 2015
Tłumaczenie: Małgorzata Koraszewska
Artykuł ukazał się pierwotnie w Listach z naszego sadu




